Medikamente werden zwar vor der Markteinführung an Patienten getestet, doch sobald ein Mittel auf dem Markt ist, wird es von einem viel breiteren Personenkreis genutzt, der sich hinsichtlich Alter, Geschlecht, Vorerkrankungen, Gesundheitszustand, Lebensumstände oft deutlich von der Testgruppe unterscheidet. Nebenwirkungen – auch bisher unbekannte – werden dadurch wahrscheinlicher.
Daher ist es notwendig, bereits am Markt eingeführte Medikamente kontinuierlich zu überwachen. Um die Arzneimittelsicherheit auch nach der Markteinführung zu überprüfen, zu verbessern und insbesondere schwerwiegende Nebenwirkungen, Wechselwirkungen oder auch eine ausbleibende Wirkung zu verhindern, gibt es weltweit genaue Vorgaben für Pharmaunternehmen, wie diese Informationen zu erfassen sind.
Uneinheitliche Informationen erfassen
Da die Informationen zu unerwünschten Wirkungen jedoch aus den unterschiedlichsten Quellen stammen können, gibt es eine große Bandbreite hinsichtlich Vollständigkeit, Detailtiefe, medizinischer Genauigkeit, Format oder Qualität. Denn Unternehmen bekommen Informationen nicht nur von medizinisch geschultem Personal wie Ärzten oder Apothekern, sondern auch von Patienten, aus Medienberichten oder dem Internet.
Diese Informationen gilt es, nach einheitlichen formalen, inhaltlichen und technischen Vorgaben zu erfassen, zu prüfen, zusammenzuführen und daraus den sogenannten Individual Case Safety Report (ICSR) zu erstellen. Außerdem sind bestimmte Fristen für die Übermittlung an die zuständige nationale Arzneimittelbehörde einzuhalten. Für Fälle mit schwerwiegenden Nebenwirkungen und solchen mit Todesfolge ist die Übermittlungsfrist kürzer.
Im ICSR müssen für jeden einzelnen Fall folgende Informationen erfasst werden:
Daten zum Patienten (zum Beispiel Alter, Geschlecht, Größe, Gewicht, Vorerkrankungen und so weiter),
Angaben und Kontaktdaten zur berichtenden Person (beispielsweise Arzt, Apotheker),
Beschreibung der unerwünschten Wirkung (zum Beispiel Zeitpunkt, Dauer, Art und Schwere des Vorfalls, Befunde und so weiter) und
Informationen zum Arzneimittel, das im Verdacht steht, die Reaktion ausgelöst zu haben (beispielsweise Name, Darreichungsform, Dosis, Dauer der Einnahme, Indikation und so weiter).
Die zahlreichen Arbeitsschritte für jeden Fall umfassen die Aufnahme, die Datenerfassung, die Qualitätskontrolle, die medizinische Prüfung und die Übermittlung. Da je nach Quelle die Angaben sehr unterschiedlich und oft unvollständig sind, ist Pharmakovigilanz ein zeit- und personalaufwendiger Prozess. Und um beispielsweise die Beschreibung eines medizinischen Laien verstehen, einordnen und in die entsprechende Fachterminologie übersetzen zu können, sind medizinische Fachleute erforderlich.
Pharmakovigilanz automatisieren
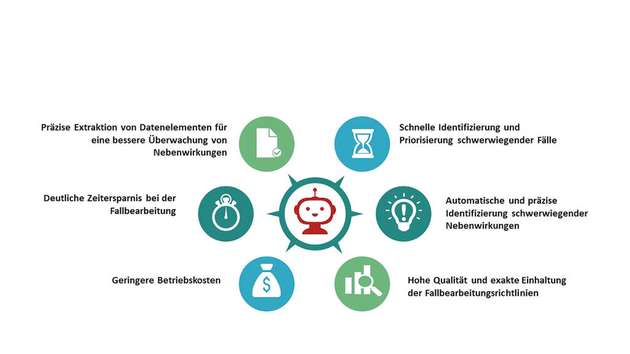
Pharmaunternehmen können mit Robotic Process Automation und Künstlicher Intelligenz viele dieser Prozessschritte automatisiert erledigen. Dadurch wird sowohl die Einheitlichkeit des Prozesses gewährleistet wie auch die Qualität – und damit die Arzneimittelsicherheit – erhöht. Gleichzeitig hilft ihnen die Automatisierung, Zeit und Kosten zu sparen sowie ihre Fachkräfte von Routineaufgaben zu befreien.
Tech Mahindra bietet Pharmaunternehmen eine Lösung, die eine bewährte IT-Plattform mit BPO (Business Process Outsourcing) Services kombiniert. Die durchgängige Ende-zu-Ende-Plattform Robovigilance basiert auf dem Fallmanagement für Nebenwirkungen der Argus Safety Suite und eignet sich für alle Sicherheitsdatenbanken. Ein Team aus medizinischen Fachleuten des Anbieters übernimmt die Tätigkeiten, die (noch) manuelles Eingreifen erfordern.
Alle wichtigen ICSR-Prozessschritt, von Falleingang und –annahme über Sichtung und Eingabe in die Sicherheitsdatenbank bis hin zur Qualitätsprüfung, sind in Robovigilance abgebildet. Die Plattform kann sowohl vor Ort installiert als auch Cloud-basiert genutzt werden.
Damit die Lösung die alltägliche Arbeit bestmöglich unterstützt, entwickelt Tech Mahindra die Anwendungs- und Automationslogik nach einer Analyse des jeweiligen Prozesses für jedes Unternehmen individuell. Erst danach wird die Lösung implementiert.
Zeitaufwand reduziert auf ein Zehntel
Die ersten Praxiserfahrungen zeigen, dass sich durch Robovigilance die Zeit für die Fallbearbeitung im Vergleich zur manuellen Bearbeitung auf ein Zehntel verkürzt. Neben der signifikanten Zeit- und Kostenersparnis können Pharmaunternehmen damit regulatorische Auflagen leichter erfüllen, schwerwiegende Nebenwirkungen frühzeitig erkennen und das Risiko von Rückrufaktionen sowie Rechtsstreits minimieren.
Mithilfe von KI lassen sich die wesentlichen Daten und Informationen für den ICSR in den eingehenden, unstrukturierten Dokumenten einfach identifizieren sowie verschiedene Aspekte analysieren. So können die Nebenwirkungen selbst, die Schwere, Folgen, Behandlungsdetails und Zusammenhänge des Vorfalls bewertet werden.
Durch Big Data Analytics können Unternehmen herausfinden, wie es durch das fragliche Arzneimittel zu den unerwünschten Nebenwirkungen gekommen ist. Zudem lassen sich durch die Datenanalyse Muster und Trends sowie Neben- oder Wechselwirkungen schneller und klarer identifizieren, als es Fachleuten aufgrund der Datenmenge jemals möglich wäre.