Das Team um Devleena Samanta und Anna Capasso (The University of Texas at Austin, USA) hat gezeigt, dass diese Nanosonden mehrere aktive Proteasen parallel nachweisen können (Multiplex-Messungen). Die Methode arbeitet bei Raumtemperatur und benötigt weder komplizierte Probenvorbereitungen noch aufwendige Geräte.
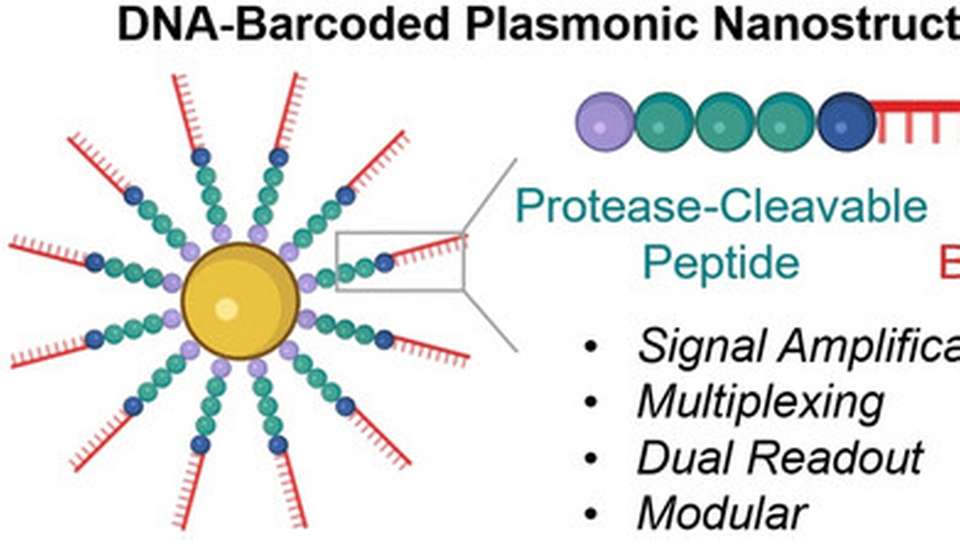
Herzstück sind neuartige Sonden: Gold-Nanopartikel, die mit Ketten aus einem Peptid- und einem DNA-Teil bestückt sind. Das Peptid ist so aufgebaut, dass es von der interessierenden Protease gespalten wird. Die DNA dient als einzigartiger Barcode zur Identifikation des Peptids und außerdem als Signalverstärker. Ist die gesuchte Protease in aktiver Form in der Probe, spaltet sie das Peptid, der DNA-Barcode wird dadurch in die Lösung freigesetzt und lässt sich, basierend auf seiner Sequenz, spezifisch nachweisen.
Methode ist ein CRISPR/Cas12a-Test
Für diesen Nachweis verwendet das Team einen CRISPR/Cas12a-Test: Das Enzym Cas12a ist an eine Guide-RNA (gRNA) gebunden, mit der es einen inaktiven Komplex bildet. Die gRNA enthält einen Abschnitt, der den DNA-Barcode spezifisch bindet. Das aktiviert Cas12a, sodass es nun einzelsträngige DNA (ssDNA) „zerschneiden“ kann.
Für den Test werden ssDNA-Moleküle zugegeben, die an einem Ende eine fluoreszierende Gruppe (Fluorophor) tragen, am anderen einen Quencher, ein Molekül, das die Fluoreszenz des Fluorophors „auslöscht“ – wenn sie sich nah genug kommen. Wird die ssDNA zerschnitten, trennen sich Fluorophor und Quencher. Es entsteht eine starke Fluoreszenz, die anzeigt, dass die gesuchte Protease vorhanden ist (Nachweisgrenze ca. 58 pM).
Nachweis kann auch ohne Gerät erfolgen
Sind vor Ort keine Geräte verfügbar und muss es schnell gehen, kann der Nachweis auch mit dem bloßen Auge erfolgen: Spaltet die Protease das Peptid der Sonde, ändert sich die Oberflächenladung der Gold-Nanopartikel und sie ballen sich zusammen (aggregieren). Als „plasmonische Nanostrukturen“ hängt ihre Farbe maßgeblich vom Grad der Aggregation ab. Nanomolare Protease-Konzentrationen sind bereits anhand der Farbänderung der Testlösung erkennbar.
Mit einer Multiplex-Detektion der Proteasen 3CL und Caspase3 konnte das Team die hohe Empfindlichkeit und Selektivität des neuen Ansatzes demonstrieren. 3CL ist ein Marker für aktive Corona-Infektionen und Covid-Patienten zeigen oft erhöhte Aktivitäten des Apoptose-Markers Caspase3.
Das klinische Potenzial konnte zudem gezeigt werden, indem Cathepsin B, eine mit kolorektalem Krebs in Verbindung stehende Protease, in drei verschiedenen von Patienten gewonnen Tumor-Zelllinien nachgewiesen wurde.
Frühzeitige Erkennung von Krankheiten möglich
Diese Nanosonden ergeben hundertfach stärkere Fluoreszenz-Signale verglichen mit kommerziellen Fluoreszenz-basierten Protease-Sensoren. Zudem kann praktisch jede Protease detektiert werden, wenn das Peptid, das diese spaltet, bekannt ist.
Diese Nanosonden könnten so eine frühzeitige Erkennung von Krankheiten ermöglichen und die Genauigkeit und Verlässlichkeit diagnostischer Tests durch Multiplexing erhöhen.