In Zellen sind chemische Reaktionen in kompartimentierten Enzymsystemen organisiert – das heißt, Reaktionen finden in räumlich begrenzten Bereichen, sogenannten Kompartimenten, statt. Dadurch werden spezifische Bedingungen für jede Reaktion geschaffen und die Effizienz und Kontrolle der biochemischen Prozesse verbessert. Inspiriert von diesen natürlichen Systemen hat das Forscherteam an der Universität Duisburg-Essen (UDE) unter der Leitung von Prof. Dr. Barbara Saccà vom Zentrum für Medizinische Biotechnologie (ZMB) in Zusammenarbeit mit dem Labor von Prof. Dr. Hemmo Meyer eine künstliche Struktur gebaut, die in verschiedene Bereiche unterteilt ist und spezifische Reaktionen vermittelt.
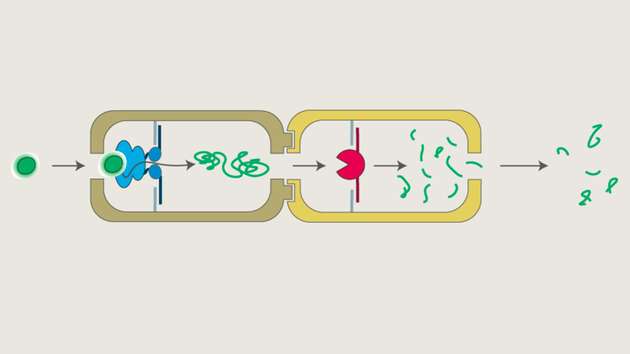
Dafür verwenden sie die DNA-Origami-Methode, eine Technik, bei der DNA-Moleküle wie winzige Bausteine gefaltet werden, um sehr kleine Strukturen zu formen. „Da die Wechselwirkungen zwischen den DNA-Bestandteilen genau bekannt sind, können wir die Struktur, in die sich der Strang faltet, präzise designen – auf Nanometer genau“, erklärt die studierte Chemikerin. In dem Modell der UDE-Wissenschaftler und Wissenschaftlerinnen besteht die künstliche Nanofabrik aus zwei solcher Strukturen, die je einen Hohlraum umschließen.
Das Potenzial der DNA-Nanotechnologie
Im ersten Teil ist die Proteinentfaltungsmaschine p97 fest verankert, die – wie ihr Name besagt – Proteine entfaltet. In seiner nun länglichen Form wird das Protein anschließend kontrolliert in den zweiten Bereich transportiert. Dort ist eine Protease gebunden, die den Proteinstrang in kleine Fragmente zerlegt. Durch die räumliche Verbindung der beiden Teilprozesse wird die Reaktion deutlich effizienter: Die Reaktionsgeschwindigkeit steigt um das Zehnfache, unerwünschte Nebenreaktionen werden um fast das Sechsfache reduziert im Vergleich zu zwei auseinanderliegenden Reaktionen, die zudem räumlich nicht abgeschottet sind.
„Unsere Ergebnisse zeigen das Potenzial der DNA-Nanotechnologie zur Programmierung modularer und kompartimentierter Enzymsysteme und eröffnen neue Wege für die synthetische Biologie und biokatalytische Anwendungen“, sagt Saccà. Für die Zukunft plant die Professorin für Bionanotechnologie, die Origami-Fabriken weiter zu verbessern:
durch die Beschichtung des Origami mit organischen oder anorganischen Materialien, die das Konzept einer semipermeablen Membran nachahmen,
indem der Zugang zur Reaktionskammer nur noch an einer Stelle möglich wird und so die Prozesse im Innern besser gegen äußere Einflüsse geschützt sind.
„Fortschritte dieser Art könnten zur Entwicklung von Miniaturlaboratorien führen, deren Fähigkeiten über die natürlichen Systeme hinausgehen“, erklärt Prof. Dr. Barbara Saccà vom Zentrum für Medizinische Biotechnologie (ZMB).













.jpg.jpg)
